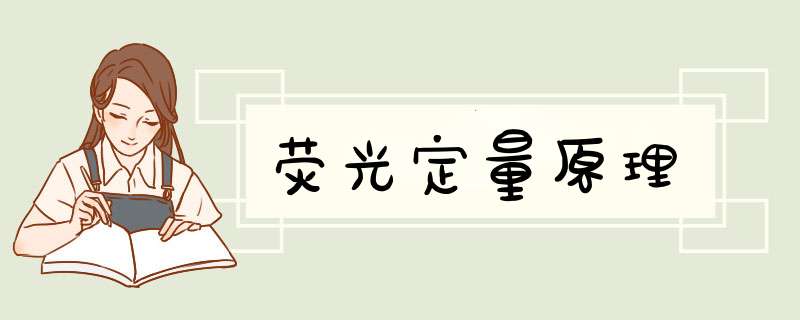
Ct=-1/lg(1+Ex)*lgX0+lgN/lg(1+Ex)。
n为扩增反应的循环次数,X0为初始模板量,Ex为扩增效率,N为荧光扩增信号达到阈值强度时扩增产物的量。
起始拷贝数越多,Ct值越小。利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代Ct值。因此,只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数。
扩展资料
传统定量PCR方法简介:
1)内参照法:在不同的PCR反应管中加入已定量的内标和引物,内标用基因工程方法合成。上游引物用荧光标记,下游引物不标记。
在模板扩增的同时,内标也被扩增。在PCR产物中,由于内标与靶模板的长度不同,二者的扩增产物可用电泳或高效液相分离开来,分别测定其荧光强度,以内标为对照定量待检测模板。
2)竞争法:选择由突变克隆产生的含有一个新内切位点的外源竞争性模板。在同一反应管中,待测样品与竞争模板用同一对引物同时扩增(其中一个引物为荧光标记)。
扩增后用内切酶消化PCR产物,竞争性模板的产物被酶解为两个片段,而待测模板不被酶切,可通过电泳或高效液相将两种产物分开,分别测定荧光强度,根据已知模板推测未知模板的起始拷贝数。
参考资料来源:百度百科-荧光定量PCR
荧光定量PCR 实验步骤: ①取冻存已裂解的细胞,室温放置5分钟使其完全溶解。
②两相分离 每1ml的TRIZOL试剂裂解的样品中加入0.2ml的氯仿,盖紧管盖。手动剧烈振荡管体15秒后,15到30℃孵育2到3分钟。4℃下12000rpm离心15分钟。离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。RNA全部被分配于水相中。水相上层的体积大约是匀浆时加入的TRIZOL试剂的60%。
③RNA沉淀 将水相上层转移到一干净无RNA酶的离心管中。加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10分钟后,于4℃下12000rpm 离心10分钟。此时离心前不可见的RNA沉淀将在管底部和侧壁上形成胶状沉淀块。
④RNA清洗 移去上清液,每1mlTRIZOL试剂裂解的样品中加入至少1ml的75%乙醇(75%乙醇用DEPCH2O配制),清洗RNA沉淀。混匀后,4℃下7000rpm离心5分钟。
⑤RNA干燥 小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10分钟。
⑥溶解RNA沉淀 溶解RNA时,先加入无RNA酶的水40μl用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80℃待用。 1)紫外吸收法测定
先用稀释用的TE溶液将分光光度计调零。然后取少量RNA溶液用TE稀释(1:100)后,读取其在分光光度计260nm和280nm处的吸收值,测定RNA溶液 浓度和纯度。
① 浓度测定
A260下读值为1表示40 μg RNA/ml。样品RNA浓度(μg/ml)计算公式为:A260 ×稀释倍数× 40 μg/ml。具体计算如下:
RNA溶于40 μl DEPC水中,取5ul,1:100稀释至495μl的TE中,测得A260 = 0.21
RNA 浓度= 0.21 ×100 ×40 μg/ml = 840 μg/ml 或 0.84 μg/μl
取5ul用来测量以后,剩余样品RNA为35 μl,剩余RNA总量为:
35 μl × 0.84 μg/μl = 29.4 μg
②纯度检测
RNA溶液的A260/A280的比值即为RNA纯度,比值范围1.8到2.1。
2)变性琼脂糖凝胶电泳测定
①制胶
1g琼脂糖溶于72ml水中,冷却至60℃,10 ml的10× MOPS电泳缓冲液和18 ml的37% 甲醛溶液(12.3 M)。
10×MOPS电泳缓冲液
浓度 成分
0.4M MOPS,pH 7.0
0.1M 乙酸钠
0.01M EDTA
灌制凝胶板,预留加样孔至少可以加入25 μl溶液。胶凝后取下梳子,将凝胶板放入电泳槽内,加足量的1×MOPS电泳缓冲液至覆盖胶面几个毫米。
②准备RNA样品
取3μgRNA,加3倍体积的甲醛上样染液,加EB于甲醛上样染液中至终浓度为10μg/ml。加热至70℃孵育15分钟使样品变性。
③电泳
上样前凝胶须预电泳5min,随后将样品加入上样孔。5–6V/cm电压下2h,电泳至溴酚兰指示剂进胶至少2–3cm。
④紫外透射光下观察并拍照
28S和18S核糖体RNA的带非常亮而浓(其大小决定于用于抽提RNA的物种类型),上面一条带的密度大约是下面一条带的2倍。还有可能观察到一个更小稍微扩散的带,它由低分子量的RNA(tRNA和5S核糖体RNA)组成。在18S和28S核糖体带之间可以看到一片弥散的EB染色物质,可能是由mRNA和其它异型RNA组成。RNA制备过程中如果出现DNA污染,将会在28S核糖体RNA带的上面出现,即更高分子量的弥散迁移物质或者带,RNA的降解表现为核糖体RNA带的弥散。用数码照相机拍下电泳结果。 ①反应体系 序号 反应物 剂量 1 逆转录buffer 2μl 2 上游引物 0.2μl 3 下游引物 0.2μl 4 dNTP 0.1μl 5 逆转录酶MMLV 0.5μl 6 DEPC水 5μl 7 RNA模版 2μl 8 总体积 10μl 轻弹管底将溶液混合,6000rpm短暂离心。
②混合液在加入逆转录酶MMLV 之前先70℃干浴3分钟,取出后立即冰水浴至管内外温度一致,然后加逆转录酶0.5μl,37℃水浴60分钟。
③取出后立即95℃干浴3分钟,得到逆转录终溶液即为cDNA溶液,保存于-80℃待用。 管家基因(β-actin)实时定量PCR
①β-actin阳性模板的标准梯度制备 阳性模板的浓度为1011,反应前取3μl按10倍稀释(加水27μl并充分混匀)为1010,依次稀释至109、108、107、106、105、104,以备用。
②反应体系如下:
标准品反应体系 序号 反应物 剂量 1 SYBR Green 1 染料 10μl 2 阳性模板上游引物F 0.5μl 3 阳性模板下游引物R 0.5μl 4 dNTP 0.5μl 5 Taq酶 1μl 6 阳性模板DNA 5μl 7 ddH2O 32.5μl 8 总体积 50μl 轻弹管底将溶液混合,6000rpm短暂离心。
管家基因反应体系: 序号 反应物 剂量 1 SYBR Green 1 染料 10μl 2 内参照上游引物F 0.5μl 3 内参照下游引物R 0.5μl 4 dNTP 0.5μl 5 Taq酶 1μl 6 待测样品cDNA 5μl 7 ddH2O 32.5μl 8 总体积 50μl 轻弹管底将溶液混合,6000rpm短暂离心。
③制备好的阳性标准品和检测样本同时上机,反应条件为:93℃2分钟,然后93℃ 1分钟,55℃ 2分钟,共40个循环。 ①针对每一需要测量的基因,选择一确定表达该基因的cDNA模板进行PCR反应。
反应体系: 序号 反应物 剂量 1 10×PCR缓冲液 2.5 ul 2 MgCl2溶液 1.5 ul 3 上游引物F 0.5 ul 4 下游引物R 0.5 ul 5 dNTP混合液 3 ul 6 Taq聚合酶 1 ul 7 cDNA 1 ul 8 加水至总体积为 25ul 轻弹管底将溶液混合,6000rpm短暂离心。
35个PCR循环(94℃1分钟;55℃1分钟;72℃1分钟); 72℃延伸5分钟。
②PCR产物与 DNA Ladder在2%琼脂糖凝胶电泳,溴化乙锭染色,检测PCR产物是否为单一特异性扩增条带。
③将PCR产物进行10倍梯度稀释: 设定PCR产物浓度为1×1010,依次稀释至109、108、107、106、105、104几个浓度梯度。 ①所有cDNA样品分别配置实时定量 PCR反应体系。
体系配置如下: 序号 反应物 剂量 1 SYBR Green 1 染料 10 ul 2 上游引物 1ul 3 下游引物 1ul 4 dNTP 1ul 5 Taq聚合酶 2ul 6 待测样品cDNA 5ul 7 ddH2O 30ul 8 总体积 50 ul 轻弹管底将溶液混合,6000rpm短暂离心。
②将配制好的PCR反应溶液置于Realtime PCR仪上进行PCR扩增反应。反应条件为:93℃2分钟预变性,然后按93℃ 1分钟,55℃1分钟,72℃1分钟,共40做个循环,最后72℃7分钟延伸。 各样品的目的基因和管家基因分别进行Realtime PCR反应。PCR产物与 DNA Ladder在2%琼脂糖凝胶电泳,GoldView染色,检测PCR产物是否为单一特异性扩增条带。
欢迎分享,转载请注明来源:夏雨云

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)