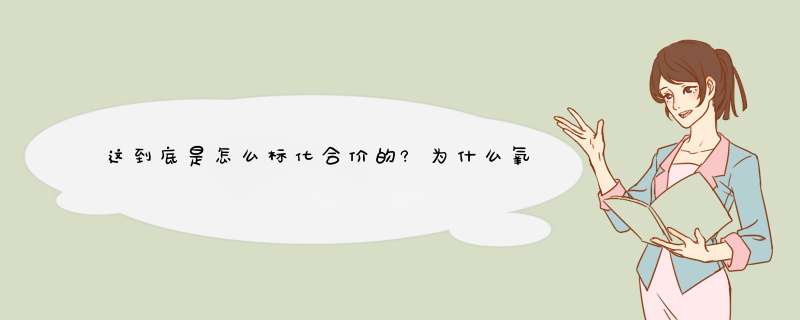
过氧化钙中的氧,一个和钙形成离子键,另一个和另一个氧形成共价键,可以看成这里的氧是-1价,在形成氢氧化钙的过程中,相当于一个氧的电子到另一个氧上去,成为一个是0价,另一个是-2价,化合价的变动是在过氧化钙中的两个氧发生的,而水中的氧,化合价没变,所以,过氧化钙在这里即使氧化剂也是还原剂。
根据图示信息,可得出:滤液A的成分有硝酸钙和硝酸铁以及剩余的硝酸,当pH至8-9范围段内时,三价铁可易形成沉淀,所以滤渣B是氢氧化铁,滤液B是硝酸钙,和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤,沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,再失水成为无水氯化钙,双氧水可以和氯化钙反应生成过氧化钙和盐酸.(1)碳酸钙和硝酸铵的混合物过滤后,所得沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,CaCO3 和稀盐酸反应的实质是:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:ABE;CaCO3+2H+=Ca2++CO2↑+H2O;
(2)用氨水调节pH至8-9,三价铁可易形成沉淀,从而分离出硝酸钙溶液,故答案为:除去Fe3+ (或使Fe3+转化为Fe(OH)3沉淀被除去);
(3)若测得滤液C中c(CO32-)=10-3 mol/L,Ksp(CaCO3)=4.96×10-9;Ksp=Ca2++CO32-=10-3 mol/L×c(Ca2+)=4.96×10-9 ,c(Ca2+)=4.96×10-6 mol/L,已知c(Ca2+)≤10-5mol/L可视为沉淀完全,所以此时钙离子沉淀完全;故答案为:是;
(4)硝酸钙和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤所得滤液主要成分是硝酸铵,故答案为:NH4NO3;
(5)双氧水可以和氯化钙反应生成过氧化钙和盐酸,即CaCl2+H2O2=CaO2↓+2HCl,故答案为:CaCl2+H2O2=CaO2↓+2HCl.
氧化钙的电子式如下图:
化学中常在元素符号周围用黑点“.”和叉“×”来表示元素原子的最外层电子。这种表示的物质的式子叫做电子式。但是,中学所学习的经典的八隅体的电子式属于过时的理论,只能用于表示很少一部分由主族元素形成的物质,不能表示由过渡元素形成的物质,亦不能正确表示多种常见物质的结构。
扩展资料:
氧化钙溶于酸类、甘油和蔗糖溶液,几乎不溶于乙醇。相对密度3.32~3.35。熔点2572℃。沸点2850℃。折光率1.838。
氧化钙为碱性氧化物,对湿敏感。易从空气中吸收二氧化碳及水分。与水反应生成氢氧化钙(Ca(OH)2)并产生大量热,有腐蚀性。
参考资料来源:
百度百科-氧化钙
欢迎分享,转载请注明来源:夏雨云

 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)