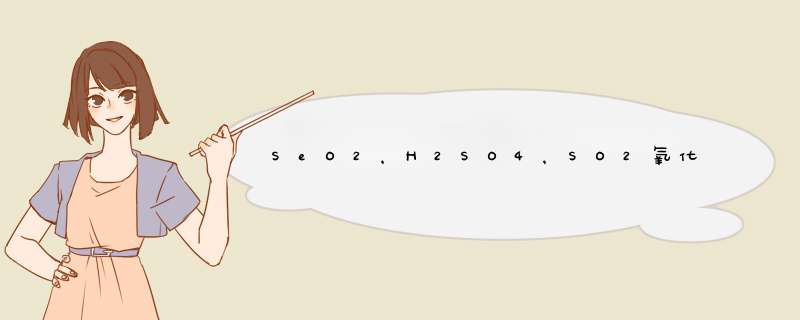
1 结论:亚硒酸氧化性大于亚硫酸其中硒最外层s
电子(4s)比硫最外层s电子(3s)难以失去!----这就是产生硒酸特强的氧化性的根源!而硒最外层p电子(4p)却比硫最外层p电子(3p)容易失去!----这就是硒酸和亚硒酸在区分性酸性溶剂中的总体酸性强度(最能决定酸强度的第一步电离)低于硫酸和亚硫酸的根源!2 2HCl+H2SeO4=H2SeO3+H2O+Cl2.根据这个方程式可知据氧化剂氧化性大于氧化产物氧化性 还原剂还
原性大于还原产物还原 可知:硒酸氧化性大于氯气 3 SeO2>SO2.SO2氧化性强所谓氧化性就是把物质的化学价提高的能力,还原性就是把化学价降低的能力.se和s,核外
价电子一样,s比se排列靠前,所以so2氧化性更强.原因就是s的核内质子和比较少,质子对电子的束缚能力要比se弱,所以s的价电子更容易与其他物质起化学反应.因为氧化性更强,反之,还原性更弱Se + 2 H2SO4(浓) ==△== SeO2 + 2 SO2 + 2 H2O
氧化性:氧化剂H2SO4>氧化产物SeO2
3 SeO2 + 2 H2S = 3 Se + 2 SO2 + 2 H2O
氧化性:氧化剂 SeO2>氧化产物SO2
合起来就是 H2SO4(浓)>SeO2>SO2
元素周期表中,同主族元素氧化性从上到下递减,所以氧化性S强于Se,而氧化性指得电子能力大小,得电子能力强,则失电子能力弱,元素还原性在离子表现出来就是还原性硫离子<硒离子.同主族元素还原性从上到下递增,如第一主族,碱金属还原性递增,最高价氧化物的酸性(氧化性)递增.所以规律,同主族元素氧化性从上到下递减,还原性递增,氧化物氧化性递增.


 微信扫一扫
微信扫一扫
 支付宝扫一扫
支付宝扫一扫
评论列表(0条)